HŐTAN - ELŐADÁSANYAG
A hőtan első főtétele. Hőmennyiség. Térfogati munka.
Belső energia formák: túlnyomás, fosszilis (kémiai kötés), atomenergia (elektrosztatikus),
A hőtan első főtétele. Hőmennyiség. Térfogati munka.
A hőtan főtételei (alaptörvényei, axiómái)
A hőtan kiépítésénél hasonló módon járunk el, mint a mechanikában. Feltétel nélküli állítások formájában (axiómák, itt a bevett szóhasználat a főtétel) fogalmazzuk meg a legáltalánosabb törvényszerűségeket, amelyekből lehet levezetni az összes többi törvényszerűséget.
A termodinamika alapfogalmai: belső energia, térfogati munka, hő, hőközlés, hőegyensúly, hőfolyamat, (zárt) termodinamikai rendszer, stb.
A hőfolyamat kiegyenlítődési folyamat, amely során az energiacsere addig tart, amíg a kölcsönhatásban levő testek hőmérséklete egyenlővé nem válik.
Extenzív mennyiségek: tömeggel (kiterjedéssel) arányos mennyiségek: tömeg, térfogat energia, töltés, stb.
Intenzív mennyiségek: tömegtől nem függő mennyiségek: nyomás, sűrűség, hőmérséklet, elektromos feszültség, stb.
A hőtan nulladik főtétele: Az intenzív állapotjelzőkben fellépő különbségek spontán folyamatokban kiegyenlítődnek. Másképpen: ha két test külön- külön hőegyensúlyban van egy harmadik testtel, akkor egymással is hőegyensúlyban van.
A hőtan első főtétele. Hőmennyiség. Térfogati munka.
I. axióma: (A hőtan első főtétele): Egy rendszer belső energiájának megváltozása (DE) egyenlő a rendszerrel közölt hő (Q) és a rendszeren végzett munka előjelesen vett összegével (W):
![]() (h1.1)
(h1.1)
Az első főtétel az energia megmaradás elvét fogalmazza meg. Elsőfajú perpetuum mobile nem szerkeszthető. Energia dimenziójú egyenlet, tehát mindegyik tagjának (így a Q-nak is) a mértékegysége a Joule.
Def.: A rendszerrel közölt hő arányos a c fajhővel, az m anyagmennyiséggel és a DT hőmérséklet különbséggel (előjelét a rendszer szempontjából válsztjuk pozitívnak, azaz pozitív, ha a testet melegítjük):
![]() (h1.2)
(h1.2)
A fajhő mértékegysége: J/(kg K)
Def.: A „rendszeren végzett munkák” közül gázok leírásánál leggyakrabban a térfogati munkát használják, amelynek legegyszerűbb alakja a következő (előjelét a rendszer szempontjából válsztjuk pozitívnak, azaz pozitív, ha a gázmennyíiséget összenyomjuk):
![]() (h1.3)
(h1.3)
Az ideális gázok speciális állapotváltozásai.
1. Izochor állapotváltozás (V=áll.)
W=0
®
![]()
![]() (h1.4)
(h1.4)
A belső energia a gáz mennyiségén kívül csak az abszolút hőmérséklettől függ.
![]() (h1.5)
(h1.5)
Itt a cv az állandó térfogaton vett fajhő.
2. Izobár állapotváltozás (p=áll.)
![]() ®
®
![]() (h1.6)
(h1.6)
![]() (h1.7)
(h1.7)
Itt a cp az állandó nyomáson vett fajhő
A cp és a cv között a következő összefüggés áll fenn:
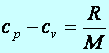 (h1.8)
(h1.8)
3. Izoterm állapotváltozás (T=áll.)
DT=0
®
![]() (h1.9)
(h1.9)
Ekkor a fajhő végtelen lenne, mivel van hőfelvétel, de nincs hőmérséklet változás.
4. Adiabatikus állapotváltozás. (Q=0)
Adiabatikus állapotváltozás, amikor a rendszer részéről a hőtani folyamat során nincs hőfelvétel, hőleadás, azaz Q=0.
![]() (h1.10)
(h1.10)
Megjegyzés: Ez az eset felelne meg ideálisan a hőerőgépeknek, mivel ilyenkor az alkalmazott „fűtőanyag” teljes belső energiája munkavégzésre fordítódna és nem következne be a gép számára hőközlés. Az adiabatikusságot a motoriparban úgy próbálják minél jobban megközelíteni, hogy egy körfolyamatát minél rövidebbre veszik, hogy azalatt minél kisebb legyen a hőleadás.
Az ideális gázok adiabatikus állapotváltozásait a következő egyenlet írja le:
![]() ahol
ahol
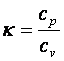 (h1.11)
(h1.11)
Alkalmazási területek, eszközök
Gőzgépek
Belső égésű motorok.
Hűtőgépek, hőszivattyúk.
Fajhőmérők
Hőmennyiség mérők