HŐTAN - ELŐADÁSANYAG
A hőtan (termodinamika) fenomenológiai, korpuszkuláris leírás módjai
Állapothatározók: Hőmérséklet. nyomás, térfogat, anyagmennyiség, részecskeszám.
Az ideális gáz állapotváltozásai, fenomenológiai állapotegyenlete. Egyetemes gázállandó
Az ideális gáz korpuszkuláris állapotegyenlete. Botzmann állandó.
A hőtan (termodinamika) fenomenológiai, korpuszkuláris leírás módjai
A hideg, a meleg hétköznapi fogalmaink Ezek az ember által történő érzékelésen alapszanak. A hőátadást kétszáz évvel ezelőtt hő-folyadék (flogiszton) terjedésével értelmezték.
Def.: A hőtan, vagy termodinamika körébe tartozik minden olyan jelenség, amely a tárgyak, közegek hőállapotával vagy a hőközléssel kapcsolatosak.
A hő jelenségek leírását (fenomenológiai hőtan) hagyományosan megtehetjük makroszkópikusan mérhető mennyiségek bevezetésével.
A fenomenológikus termodinamika a makroszkópikus testek energiafajtáinak egymásba való kölcsönös átalakulásaival, a test állapotváltozásainak, környezetével való legáltalánosabb kölcsönhatásainak vizsgálatával és leírásával foglalkozik.
Az atomfogalom térhódításába beletartozott a fenomenológiai mennyiségek atomi paraméterekből történő származtatása (molekuláris, vagy kinetikus gázelmélet).
A molekuláris hőelmélet az anyagot alkotó részecskékről készített modell segítségével, e részecskék mozgásával és kölcsönhatásával magyarázza az anyag makroszkópikusan tapasztalt megnyilvánulásait.
A statisztikus fizika a makroszkópikus anyaghalmazok tulajdonságait a molekulák sokaságára alkalmazott valószínűség számítás módszereivel írja le.
Állapothatározók: Hőmérséklet. nyomás, térfogat, anyagmennyiség, részecskeszám.
A hőtan, a három mechanikai alapmennyiség után bevezet egy újabbat. Az emberi hideg-meleg fogalom objektív, mennyiségi jellemzésére szolgál a hőmérséklet (jobb szó erre a nem magyar temperatura szó, aminek az első kezdőbetűje (t) lett ennek a jele). A hőtan alapmennyisége tehát a hőmérséklet.
Egy alacsonyabb hőmérsékletet követő magasabb hőmérséklet számos fizikai paraméter megváltozásával jár együtt. Ilyen mennyiség elsősorban a testek térfogata (sűrűsége), halmazállapota, elektromos ellenállása, színe, stb.
Ezek, a hőmérséklet változásával együtt járó egyéb változások, (térfogatváltozás, ellenállás változás), alkalmazhatók a „hőmérsékletváltozás megjelenítésére”, hőmérők készítésére.
A gyakorlatban széles körben alkalmazott hőmérők (Celsius, Fahrenheit) alappont választása, skálabeosztása önkényes.
Def.: Európában leginkább a Celsius féle hőmérsékleti skálát alkalmazzák. Jele: t. Ennek 1 atmoszféra nyomás mellett az olvadó jég állapota jelenti a 0 oC értéket, a forrásban levő víz állapota pedig a 100 oC . Egysége tehát ennek az intervallumnak az 1/100-ad része. Neve: oC (fok Celsius).
Def.: (Abszolút hőmérsékleti skála) A fizikában egy sor, a gázokra felismert törvényszerűség alapján célszerűnek látszott egy abszolút hőmérsékleti skálát bevezetni. Ennek jele a T. Mindkét alappontja a víznek az 1 atmoszféra nyomáson történő fázisátalakulásához kapcsolódik, ezek számszerű értéke 273,16 és 373,16 K. Az abszolút hőmérsékleti skála egységének ugyanakkorát választottak, mint a Celsius egység, egysége tehát ugyanakkora, mint a oC . Neve: K (Kelvin).
Def.: Ezek szerint a Kelvin-skála és a Celsius-skála közötti átszámítás módja a következő (nullpont eltolás):
![]() (9.1)
(9.1)
Def.: A hőtan a testekről, a testekben lejátszódó változásokról elsősorban munka, energia jellegű mennyiségekkel ad leírást. A hőtan által is használt mennyiségek egy része már a mechnikában bevezetésre került. A hőtani állapothatározók közül ilyen a térfogat (V) és a nyomás (p).
Def.:A hőtan molekuláris értelmezése egy újabb alapmennyiség bevezetését teszi szükségessé. Ez az alapmennyiség az anyagmennyiség, az egysége az 1 mol.
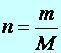 (9.1)
(9.1)
Az 1 mol anyagmennyiség tömege annyi gramm, ahányszor nagyobb az adott gáz egy molekulájának tömege (egyatomos gázoknál egy atomjának tömege) a 12-es tömegszámú szénatom 1/12-ed részénél.
A moláris tömeg jele M, mértékegysége kg/mol. A gyakorlatban a g/mol egységgel számolunk. Pl. az O2 32 g/mol, a He 4 g/mol.
Tétel: Az Avogadró-törvény azt fogalmazza meg, hogy minden gáz esetében, normál állapoton (azaz po = 105 Pa nyomáson és To = 273 K hőmérsékleten) a moláris tömeg Vo térfogata egyenlő 22,41 dm3-rel.
Az ideális gáz állapotváltozásai, fenomenológiai állapotegyenlete. Egyetemes gázállandó.
Def.:
Ideális gáz az a légnemű
halmazállapotú, adott m tömegű test, amely „hőtani mozgására”
teljesül, hogy a nyomásának és a térfogatának a szorzata arányos az
abszolút hőmérséklettel, azaz
![]() .
.
Ennek egyenlet formában történő megfogalmazása a következő:
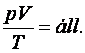 (9.2)
(9.2)
Ennek három speciális esete lehet, ezeket nevezzük az ideális gáz speciális állapotváltozásainak.
1. Az állandó hőmérsékletű (T=áll.) esetet Boyle-Mariotte-féle törvények nevezzük. Ez a nyomás (p) és a térfogat (V) fordított arányosságát fejezi ki:
![]() (9.3)
(9.3)
2. Az állandó nyomáson (p=áll.) lejátszódó esetet Gay-Lussac-féle I. törvénynek nevezzük. Ez a térfogat (V) és a hőmérséklet (T) egyenes arányosságát fejezi ki:
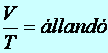 (9.4)
(9.4)
3. Az állandó térfogaton (V=áll.) lejátszódó esetet Gay-Lussac-féle II. törvénynek nevezzük. Ez a nyomás (p) és a hőmérséklet (T) egyenes arányosságát fejezi ki:
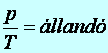 (9.5)
(9.5)
Szokás egyesített gáztörvénynek nevezni a következő formát. Ez is és minden eddigi forma két állapot összehasonlítását teszi lehetővé, függetlenül attól, hogy a két állapot között milyen „útvonalon” játszódik le állapotváltozás.
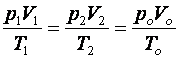 (9.6)
(9.6)
Az állapotváltozások ábrázolására leggyakrabban a p-V diagrammot, ritkábban a V-T és a p-T diagrammot használják.
Tétel: Az egyesített gáztörvénybeli kifejezés értékét a po =105 Pa, a Vo =22,41 dm3 és a To = 273 K konkrét értékeivel ki lehet számítani és ez
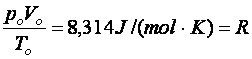 (9.7)
(9.7)
Tétel: Ha a gáz anyagmennyisége n mol, akkor a nyomás, a térfogat és a hőmérséklet közötti univerzális összefüggés a következő, amelyet az ideális gázok állapotegyenletének nevezünk. Az R (Regnault) neve pedig egyetemes gázállandó.
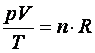 vagy
vagy
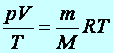 (9.8)
(9.8)
A valódi gázok állapotegyenlete. (van der Walls-féle állapotegyenlet)
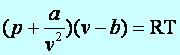 (9.20)
(9.20)
ahol v=V/m, a gáz fajlagos térfogata, b a molekulák kiterjedését veszi figyelembe, az a/v2=pk a molekulák közötti vonzóerő.
Az ideális gáz korpuszkuláris állapotegyenlete. Botzmann állandó.
Alapfogalmak
Def.: Ideális gáz: olyan test, amely igen sok részecskéből áll. Ezek a részecskék egymással és az edény falával abszolút rugalmasan ütköznek. A részecskék saját térfogatának összege elhanyagolható az edény térfogatához képest. Az ütközésen kívül számottevő kölcsönhatás nincs közöttük. A gázrészecskék nincsenek kötött állapotban, ezért betöltik a rendelkezésükre álló tetszőlegesen nagy térfogatot.
Egy részecske transzlációs kinetikai energiája:
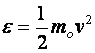 (10.5)
(10.5)
Def.: Szabadsági fokok: A hely egyértelmű megadásához szükséges adatok száma (f=6).
Def.: Atomi tömegegység: (ATE) A 12C szénizotóp egy atomja tömegének 1/12 része. 1 ATE megfelel 1,66 10-27 kg-nak.
Moláris tömeg: Az anyag annyi grammja amennyi egy részecskéje tömegének ATE-ben kifejezett értéke. Jele: M
Def.: Mol: (molnyi mennyiség): Az atomok, molekulák mennyiségének egysége, annyi elemi egységet tartalmazó mennyiség, amennyi atom a szén 12C izotópjának 12,00 g-ban van. Jele: mol.
Avogadró szám: Bármely anyag 1 móljában levő azonos részecskék száma. Jele: NA. Értéke bármely anyagra: 6 1023 /mol.
Mólok száma:
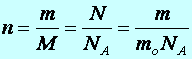 (10.6)
(10.6)
A makroszkópikus paraméterek és a mikroszerkezet közötti kapcsolat
Az ideális gáz nyomása
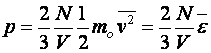 (10.7)
(10.7)
Az ideális gáz állapotegyenlete:
![]() (10.8)
(10.8)
Boltzmann-állandó: 1,38 10-23 J/K.
Az univerzális gázállandó és a Boltzmann-állandó kapcsolata:
![]() (10.9)
(10.9)
További kinetikus gázelméletbeli hőtani mennyiségek
A fajhő molekuláris hőelméleti jelentése
Hőkapacitás:
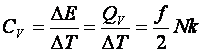 (10.10)
(10.10)
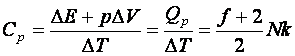 (10.11)
(10.11)
Fajhő:
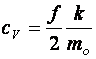 (10.12)
(10.12)
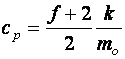 (10.13)
(10.13)
Molhők:
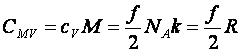 (10.14)
(10.14)
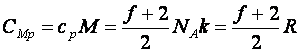 (10.15)
(10.15)
Robert-Mayer egyenlet (molhőkkel kifejezve):
![]() (10.16)
(10.16)
Az ideális gáz belső energiája:
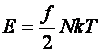 (10.17)
(10.17)
Alkalmazási területek, eszközök
Hőmérők, hőmérséklet érzéskelők
Kompresszorok
Légritkító berendezések
Nyomásérzékelők