ELEKTROMOSSÁGTAN - ELŐADÁS ANYAG
E5.
Elektromos áram elektrolitokban
Elektromos áram elektrolitokban. Faraday törvényei
Elektrolízis.
Alumínium-, acél gyártás
Elemek,
akkumulátorok, üzemanyagcella
Elektromos
feszültség hatása folyadékkristályban
Elektromos áram elektrolitokban. Faraday törvényei
Az elektrolízis során az
elektrolitokon (savak, lúgok, sók vizes oldatai) keresztül, a beléjük
merülő elektródákon keresztül áram folyik; gáz, vagy szilárd anyag válik
ki.
Faraday tapasztalati törvényei:
Faraday I. törvénye. Az m tömegű anyag kiválasztását írja le:
![]() (13.1)
(13.1)
k - anyagállandó, I - áramerősség, t - idő
Faraday
II.
törvénye
Egy molnyi mennyiség kiválasztásához
96500 C töltés szükséges.
Az Avogadró számmal "összekapcsolva": Létezik egy legkisebb töltés:
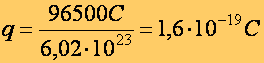 (13.2)
(13.2)
Elektrolízis.
Alumíniumgyártás
Def: Elektrolit olyan, leggyakrabban vizes oldat, amelyben sók, savak, vagy lúgok molekuláinak disszociációját követve negatív és pozitív ionok vannak jelen.
Def: Elektrolízis elektrolit oldatban elektromos áram hatására az oldatban levő negatív és pozitív ionok kiválása a katódon és az anódon.
Az elektrolízis gyakorlati felhasználási területei a következők:
1. Fémek tisztítása (raffinálás)
2. Galvanizálás (fémes bevonat készítés)
a) Korrózióvédelem
b) Díszítő célzatú galvanizálás
3. Fémelőállítás
a) Timföldelektrolízis
b) Nátrium-klorid olvadékának elektrolízise (nártium-előállítás)
Alkalmazás: alumíniumgyártás
Az alimínium oxidációjának egyenlete:
2 Al + 3 O = Al2O3 + 160 kJ (13.3)
Alumíniumgyártást 4,5 V-nál kisebb feszültséggel nem lehet végezni, mivel ennél kisebb értéknél az elektródák alumíniummal és oxigénnel vonódnak be, és az így létrejött „elem” feszültsége 4,5 V. Ennél nagyobb feszültség alkalmazásával már folyik áram az oldaton. A Joule-féle hőt a feszültség különbség alapján számolhatjuk.
Elemek,
akkumulátorok, üzemanyagcella
Def:
Az elemek kémiai áramforrások azon
csoportja, amelyekben az áram termeléskor a két különböző, elektrolitba
merülő fém között nem megfordítható átalakulás jön létre, vegyi reakció
útján szolgáltat elektromos áramot.
A reakció közben az elektródok, illetve az elektrolit kémiai összetétele megváltozik. Ennek következtében az elem egy idő után használhatatlanná válik, lemerül.
Volta-féle elem: réz és cink elektrodák között kénsav van. Ennek a feszültsége –1 V.
Leclanche szárazelem (Lapos zsebtelep): még mai is forgalomban van a három elemből álló, 4,5 Voltos telep, az elektromotoros erő elemenként –1,5 V. A negatív elektróda a henger alakú cink (–Zn) és benne szén rúd található. A cink tartályban ammónium-klorid (NH4Cl) kocsonyásított mangándioxidban (MnO2) alkotja az elektrolitot.
A bruttó reakció egyenlet:
Zn + 2 NH4Cl + MnO2 = Zn(NH3)2Cl2 + Mn2O3 + H2O (13.4)
Higanyoxidos elem:
Ebben kadmium (–Cd) és higanyoxid (+HgO) alkotják az elektródákat. Köztük kocsonyásított káliumhidroxid (KOH) az elektrolit. Az elektromotoros erő –1,344 V.
Az anódon lejátszódó reakció: Cd +2 OH- = CdO + H2O + 2e-
A katódnál lejátszódó reakció: HgO + 2e- + H2O = Hg + 2 OH-
A bruttó reakció egyenlet:
Cd +HgO = Hg +CdO (13.5)
Akkumulátorok
Def: Az akkumulátorok a kémiai áramforrások (segítségükkel a villamos energia termelése kémiai anyagok átalakulása révén történik) azon csoportja, amelyekben az átalakulás megfordítható, azaz villamos áram bevezetésével a kémiai anyagok visszaalakíthatók eredeti állapotukba, az áram termeléskor átalakult anyagok ellentétes irányú áram átbocsátásával regenerálhatók. („töltés”, „kisütés”).
Legtöbbször felépítésük alapján osztályozzák őket. A felhasználási szempontok alapján indítóakkumulátorról, vontatási vagy járműhajtó akkumulátorról, helyhez kötött vagy ipari felhasználású akkumulátorokról és vezeték nélküli készülékek akkumulátorairól eshet szó. Az akkumulátorok fejlesztésénél a cél: minél nagyobb kapacitás mellett minél kisebb méret és tömeg - vagy tudományosabban: minél nagyobb energiasűrűség.
Felépítés szerint a következőket lehet most felsorolni:
Ólom, vagy savas akkumulátor.
Oxigénrekombinációs, zárt ólomakkumulátorok
Nikkel-kadmium akkumulátor
Nikkel metál-hidrid (NiMH) akkumulátorok
Lítium-ion akkumulátor (Li-ion)
Lítium-polimer (Li-polymer) akkumulátor
Ólom, vagy savas akkumulátor.
A gépjárművek indítóakkumulátorai kivétel nélkül kénsavat tartalmazó ólomakkumulátorok. Ha egy mólnyi anyag alakul át, a töltés előállításával is járó villamos energiatermelő elektrokémiai reakció az alábbi, amely során 53,6 Ah töltés haladhat át a vezetékeken.
A bruttó reakció egyenlet:
Pb + 2 H2SO4 + PbO2 <---> 2 PbSO4 + H2O + 53,6 Ah (13.6)
Három aktív anyag játszik szerepet a savas ólomakkumulátor működésében:
– a fém ólom (Pb), amely működéskor a negatív elektród, ólomrácsra rákent szivacsos fém ólomlemez formájában,
– az ólomdioxid (PbO2), amely működéskor a pozitív elektród, villamosan vezető ólomrácsra rákent szivacsos lemez formájában,
– az ún. elektrolitként is szolgáló kénsav (H2SO4), amely a lemezeket körbeveszi és azok pórusait is kitölti.
Egy üzemelő cella feszültsége névlegesen 2 volt. Ezekből a cellakötegekből, azok sorba kötésével épül fel az akkumulátor telep. A leggyakoribb a 3, illetve 6 db sorba kötött cellából álló 6 V és 12 V névleges feszültségű telep. A magyarországi hőmérsékleti viszonyok között az üzemelő akkumulátor feltöltött állapotában a kénsav sűrűsége 1,28 kg/liter. Egy teljesen kisütött ólomakkumulátor elektrolitjának a sűrűsége 1,1 kg/liter érték alá is csökkenhet, aminek a fagyáspontja –12 –14 C°.
Oxigénrekombinációs, zárt ólomakkumulátorok
Az 1990-es évek végének legnagyobb konstrukciós változása a savas ólomakkumulátorok területén az üzemelés szempontjából zárt konstrukció megjelenése és tömeges elterjedése. Az oxigén rekombinációs akkumulátorok fordulnak elő Magyarországon is autókban, számítógépek szünetmentes áramforrásaiban, riasztókészülékek áramforrásaiban, stb. becsülhetően ma már több mint 4 milliárd forintértékben.
Nikkel-kadmium akkumulátor (NiCd)
A hatvanas években jelentek meg az első nikkel-kadmium (NiCd, anód és katód) akkumulátorok. Akkoriban ezek kínálták az egyetlen alternatívát a sav-ólom akkuk mellett. Esetükben nagy probléma a kristályképződés, pontosabban az, hogy az akkumulátor aktív részecskéi, ha sokáig nem mozgatják meg őket, hajlamosak nagyobb kristályokba összeállni, ami csökkenti az akku kapacitását. Az elektromotoros erő –1,36 V. Feszültsége gyakorlatban 1-1,25 V közötti.
A bruttó reakció egyenlet:
Cd + 2 Ni(OH)3 <-----> 2 Ni(OH)2 + Cd(OH)2 (13.6)
Nikkel metál-hidrid (NiMH) akkumulátorok
Az elmúlt 5-6 évben a legtöbb kis méretű áramforrást igénylő területen a nikkel metál-hidrid (NiMH) technológia vette át a NiCd akkumulátorok helyét. Ezekben az akkukban a pozitív oldalon a NiCd akkukhoz hasonlóan nikkelt találunk, a negatív oldalon viszont egy speciális hidrogén-megkötő fémötvözet veszi át a kadmium helyét. Töltéskor ez a fémötvözet megköti a savas elektrolit hidrogénjét, kisütéskor pedig leadja azt. A NiMH akku töltése sokkal bonyolultabb, mint a NiCd-é. A megfelelő töltésszint eléréséhez az akkumulátor hőmérsékletét is figyelembe vevő, bonyolult töltési algoritmus szükséges, ami megdrágítja a töltőáramköröket. Feszültsége 1-1,25 V.
Lítium-ion akkumulátor (Li-ion)
A legfiatalabb generációba tartozik a lítium-ion (Li-ion) technológia. Nevét onnan kapta, hogy a töltés tárolásáról lítium-ionok gondoskodnak, amelyek töltéskor a negatív, szén alapú elektródához, kisütéskor pedig a pozitív fémoxid elektródához vándorolnak. Az anódot és a katódot szerves elektrolit választja el egymástól. Ennek a típusnak a legnagyobb a kapacitása - a NiCd akkukénak kétszerese - a kimerült cella is képes legalább 3 V-ot szolgáltatni. Teljesen feltöltött állapotban mintegy 4 V a cellafeszültség. Egyetlen cellával táplálható a legtöbb modern rádiótelefon. Az előnyök között szerepel még a meglepően kis súly és az, hogy egyáltalán nem képződnek kristályok az akkumulátorban.
Lítium-polimer (Li-polymer) akkumulátor
A Li-ion utódja, a lítium-polimer (Li-polymer) akkumulátor. Hatalmas előnye, hogy nem, vagy csak nagyon kis mennyiségben tartalmaz folyékony elektrolitot, helyette speciális polimer választja el az anódot és a katódot. Ez nagyon vékony és nagyon rugalmas cellákat eredményezhet, mivel nem kell vastag falú burkolattal védekezni a folyadék kifolyása ellen. Az is elképzelhető, hogy egy szabadon hajtogatható lapocska lesz a jövő akkumulátora.
Üzemanyag cella
Nem akkumulátor, nem elem. Sokféle formában alakítottak ki már nagy teljesítményű, nagyobb, kisebb üzemanyagcellákat. Az üzemanyagcellák az elemekhez hasonlóan vegyi reakciókkal közvetlenül elektromosságot állítanak elő, a különbség az, hogy míg az elemeket kifogytuk után el kell dobni, az üzemanyagcella mindaddig üzemel, amíg üzemanyagot töltünk bele. Ez az üzemanyag legtöbbször hidrogén, de vannak metánnal és metanollal működő változatok is. A hidrogénből a reakció során víz lesz, a szénvegyületekből emellett széndioxid is képződik.
A vízbontási kísérlet során elektromosság hatására hidrogén és oxigén keletkezik a vízből. Az üzemanyagcella ennek a fordítottját végzi, megfelelő katalizátorok segítségével.
Az üzemanyagcellának számos előnye van az akkumulátorokkal szemben. Talán a legfontosabb, hogy pillanatok alatt utántölthető, és hogy várhatóan lehetséges lesz a jelenlegi akkumulátoroknál sokkal nagyobb kapacitásút előállítani belőle. Ráadásul gyakorlatilag korlátlan a cella élettartama, ami környezetvédelmi szempontból fontos.
Elektromos feszültség hatása folyadékkristályban
A korai LCD-k az 1960-as években még csak előre-definiált alakzatokat tudtak megjeleníteni 2 állású (monokróm) üzemmódban. A képpontmátrix alapú LCD-k a színes megjelenítésre alkalmasak, minimális a helyigényük és relatív alacsony fogyasztásúak.
Az LCD-képernyők alapja egy elektromos áram vezetésére alkalmas kristályos anyag, amely a folyékony és a szilárd halmazállapot között ingadozik. A folyadékkristályok általában hosszú, egyenes, pálcika alakú molekulák. A kijelzőkben használt folyadékkristályok molekuláinak egyik vége egy kissé pozitív, a másik egy kissé negatív töltésű.
Az egyszerű, monokróm háttér-világításos LCD-kijelző felépítése és működése.
Ha egy folyadékkristály-réteget barázdás üveglapok közé teszünk, akkor a molekulák a barázdák mentén helyezkednek el. Ha az egyik lapot 90 fokkal elforgatjuk, a laphoz közeli molekulák újra elrendeződnek, és merőlegesek lesznek a másik laphoz közeli molekulákra. A két lap között a kristályrács többi része negyedfordulatnyi csavart ír le. Az így kapott lapka, benne a folyadékritály molekulákkal, a rajta áthaladó fény polarizációs síkját 90 fokkal elforgatja.
Az üveglapokra kapcsolt kis feszültség hatására viszont a folyadékkristály molekulák az elektromos térnek megfelelő helyzetet veszik fel, és a folyadékkristály réteg már nem forgatja el az áthaladó fény polarizációs síkját, azaz az átmenő fényre leárnyékolást jelent. Ha a feszültséget lekapcsoljuk, a rács visszatér az előző állapotba. Tehát ezt a kis egységet feszültséggel lehet vezérelni, hogy áteressze a fényt, vagy sem.
A kijelző készítésekor az üveglapokat olyan lineáris polarizációs szűrőkkel egészítik ki, amelyek polarizációs síkja egymásra merőleges. A beérkező fényt az első szűrő polarizálja, a folyadékkristály 90 fokkal elforgatja, majd a fény áthalad a második szűrőn, és kilép a másik üveglapon. Ha feszültséget kapcsolunk a kijelző elektródájára, a beérkező fény anélkül halad át a folyadékkristályon, hogy az elforgatná a polarizációs síkot, ezért nem tud áthatolni a második polarizációs szűrőn. Az eredmény: az elektródák által lefedett felületen a kijelző elfeketedik
A háttérvilágítású, színes, un. transzmissziós LCD-megjelenítők felépítése működése:
A korszerű színes LCD-megjelenítők (tévék, monitorok) a fentiekben ismertetett alapelven működnek, de felépítésük jóval bonyolultabb. A kijelző képpontjait a szokásos RGB-színkeverés alapszíneire osztott alképpontok (sub-pixelek) alkotják. Az egyes alképpontok alapszíne a felettük elhelyezett színszűrővel határozható meg. Az alképpontokhoz tartozó elektródákon közölt feszültség finom adagolásával árnyalatok megjelenítésére képes a kijelző. A mai, aktív mátrixos LCD-kijelzők alképpontjai 256 különböző árnyalatra képesek. Kívülről befelé haladva a következő rétegek vannak egy háttérvilágítású, színes LCD-megjelenítő ernyőjében: felső védőréteg, vízszintes polárszűrő, felső üveglap, színszűrő réteg, folyadékkristály réteg, alpixel elektródái, alsó üveglap, függőleges polárszűrő, háttérvilágítás.
A háttérvilágítású LCD-panelek lassan eljutnak arra a szintre, hogy felbontásban és képméretben összevethetők a legjobb plazmamonitorokkal. Ma már egyes modellek elérik a 800:1 on/off kontrasztot – ami LCD-viszonylatban egészen jó eredmény -, felbontásuk akár meghaladhatja a HDTV-megjelenítéshez szükséges 1920x1080 képpontot, a legnagyobb képátló pedig megközelíti a 120 centis méretet