ATOMFIZIKA - ELŐADÁS ANYAG
Bohr-féle atommodell, kvantumszámok. Pauli-elv
Kvantummechanikai atommodell. Schrödinger-féle egyenlet.
Heisenberg-féle határozatlansági reláció. De Broglie-féle részecske-hullám kép.
Infravörös, látható, ultraibolya abszorpciós és emissziós színképek. Röntgen színképek
Az atomfogalom és kialakulása
Lavoisier (1743-1794) elem fogalmat használ már.
Proust (1754-1826 (1801) állandó súlyviszonyok törvénye: A kémiai elemek nem egyesíthetők vegyületekké bármilyen arányban, hanem csak egy, a vegyületekre jellemző súlyarány szerint.
Dalton (1766-1844) (1803) többszörös súlyviszonyok törvénye: Ha két elem többféle arányban is képes egymással vegyülni, akkor az egyik elem azon mennyiségei, amelyek a másik elem egy adott mennyiségével vegyülnek, úgy viszonylanak egymáshoz, mint a kis egész számok.
Avogadro (1776-1856) Avogadro törvénye: Azonos nyomás, térfogat és hőmérséklet mellett a gázok azonos számú részecskét tartalmaznak. A molnyi mennyiségben lévő molekulák száma: N=6,02 1023.
Einstein (1879-1955) (1905) Brown-mozgás értelmezése, Kilépési munka értelmezése: foton fogalom.
Bevezetett fogalmak: atomsúly, molekulasúly.
A Bohr-féle atommodell. Kvantumszámok. Pauli-elv
Ez az atommodell szemléletesen egy kis Naprendszer. A Nap helyén, az atom középen helyezkedik el a pozitív töltésű mag (Rutherford) (töltése: Ze) és körülötte keringenek a negatív töltésű elektronok (melyek tömege: m, töltése pedig: e) (J.J. Thomson). A pályák sugarai (r) és a keringési sebességek (v) az ismeretlenek A mag Coulomb-féle vonzóereje az elektronokra adja a centripetális erőt.
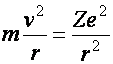 (a2.1)
(a2.1)
A kvantáltság viszont ”mesterségesen” került be ebbe a képbe, azzal a Bohr-féle kvantumfeltétellel, miszerint az elektronok csak meghatározott pályákon keringhetnek, amely pályák perdületét (pályamomentumát) Bohr a Planck-állandó egészszámú többszöröseként fejezett ki:
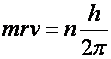 (n=1, 2, 3,...)
(a2.2)
(n=1, 2, 3,...)
(a2.2)
A két egyenlet elegendő a két ismeretlen (pályák sugarai (r) és a keringési sebességek (v)) kiszámításához.
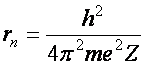 (a2.3)
(a2.3)
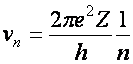 (a2.4)
(a2.4)
Ezek alapján ki lehet számítani egy elektronpályán az elektron összes mechanikai energiáját (a mozgási és a helyzeti energia összeget):
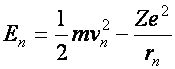
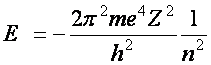 (a2.5)
(a2.5)
Egy-egy foton abszorpciója, vagy emissziója csak a meghatározott energia szintek közötti átmenetek során következik be. Tehát az egyes energiaszintek különbségéből számítható a kibocsátott foton frekvenciája (hullámhossza), azaz a színe:
![]()
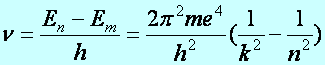 (a2.6)
(a2.6)
A konstansokból számolt érték pontosan megegyezik a hidrogén atom, adott vonalainak mért adatai alapján, a Balmer-féle tapasztalati formulából számolt Rydberg-állandóval:
![]() (a2.7)
(a2.7)
Megjegyzés: A számolt értékek egyezése a spektroszkópiai mérések eredményeivel, hatalmas sikere volt a modellnek. Ezt a modellt azonban csak érdekességként mutattuk be, a fizika a Schrödinger-féle leírásmódot alkalmazza.
Kvantumszámok
Az atomok elektronjait jellemző mennyiségeket és azok, Bohr-modellben bevezetett jelentését a táblázat foglalja össze. Az atomok elektron héjaiban levő elektronok „elrendeződésének”, a töltéseloszlásnak a szabályait a Pauli-féle kizárási elvben és a kvantum feltételekben foglaljuk össze:
Pauli-féle kizárási elv (Wolfgang Pauli, 1900-1958) Ugyanazon atomban nem lehetnek olyan elektronok, amelyeknek mind a négy kvantumszáma megegyezik.
Ennek következtében az n=1, pályán 2 elektron, az n=2 pályán 8 elektron, az n=3 pályán 8 elektron, az n=4 pályán 18 elektron, az n=5 pályán 18 elektron, az n=6 pályán 32 elektron, az n=7 pályán 10 elektron.
|
Neve |
Jele |
Értéke |
Értelmezése Bohr-modellben |
|
Főkvantum-szám |
n |
1, 2, 3,.. |
Az atom elektronjának a pálya energiája és nagysága |
|
Mellékkvan-tumszám |
l |
0, 1, 2, .....l |
Az atom elektronjának a pálya momentuma |
|
Mágneses kvantumszám |
ml |
l, (l-1),...1, 0, -1, ...-(l-1), -l |
Az atom elektronjának mágneses állapota és annak helyzete a külső mágneses térben |
|
Spin kvantumszám |
ms |
+1/2; -1/2 |
Az atom elektronjának saját perdülete |
Kvantummechanikai atommodell. Schrödinger-féle egyenlet.
Ez a leírásmód a térbeli és energetikai állapotoknak a valószínűségéről ad számot, az elektronnak az atommag körüli térrészben a tartózkodási valószínűségét adja meg. Az elektron állapotot az összenergiával (helyzeti+mozgási), a térbeli felépítéssel (szimmetria) és a töltéseloszlással (s, p, d, f) jellemzi. Alkalmazza az atompálya fogalmat, ami alatt az atommag körüli azon térrészt értjük, amelyen belül az elektron 90 %-os valószínűséggel tartózkodik. A kvantumszámok az atompályák, illetve az atomban kötött elektron jellemzésére szolgáló adatok.
Az elektron állapot adatait a Schrödinger-féle parciális differenciálegyenlet (1926) megoldásfüggvényeiből lehet nyerni. Ennek a differenciálegyenletnek a „specialitása”, hogy csak meghatározott E értékekre elégítik ki a megoldásfüggvények. Ezek az E értékek az elektron energia szintjeit adják. Ennek a leírásmódnak a sikere abban van, hogy nem szükséges semmilyen külön feltétel az elektron állapotok értékeinek (hidrogén esetében egzaktul sikerül megoldani, minden más estben közelítéssel) számolására. Az itt következő két egyenlet közül az első egy általános, egydimenziós alak, a második pedig egy konkrétabb forma).
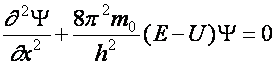 (a2.8)
(a2.8)
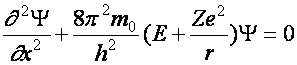 (a2.9)
(a2.9)
A Heisenberg-féle határozatlansági reláció. De Broglie-féle részecske-hullám kép,
Határozatlansági reláció
(1927) (Werner Heisenberg 1901-1976): Egy részecske helyének és
impulzusának egyidejű meghatározása nem lehetséges tetszőlegesen
pontosan. A mérési hibák szorzata nem lehet kisebb egy állandó értéknél,
bármilyen “pontos” mérőberendezést is fejlesztünk ki. Pl.
Dx
a hely, DIx pedig
az x irányú impulzus bizonytalansága.
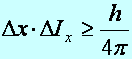 (a2.10)
(a2.10)
De Broglie-féle részecske-hullám kép,
Louis de Broglie (1892-1987); Davisson (1881-1958) Germer (1896-1971)
Az I impulzusú elektronhoz rendelhető hullámhossz:
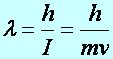 (a2.11)
(a2.11)
Az elektron sebessége U gyorsító feszültség hatására:
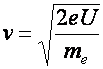 (a2.12)
(a2.12)
Pl. elektron 10 kV gyorsító feszültség esetén 25000 km/s sebességre tesz szert (TV, számítógép monitor) Ilyen feszültség mellett elektronmikroszkópban a hullámhosszára adódik:
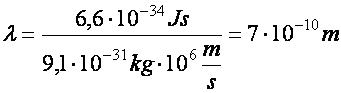 (a2.13)
(a2.13)
Fény fotonjának tömege (m), lendülete (I), alkalmazva Einstein relativitás elméleti összefüggéseit az energiára és a lendületre:
![]() (a2.13)
(a2.13)
![]() (a2.14)
(a2.14)
![]() Þ
Þ
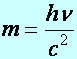 (a2.15)
(a2.15)
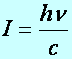 (a2.16)
(a2.16)
pl.: zöld színű fény esetében, l=500 nm, n=600 THz,
m= 4,4 10-36 kg, I=1,33 10-27 kg m/s
Infravörös, látható, ultraibolya abszorpciós és emissziós színképek.
Fényforrások (színképük): Nap, gyertya, tűz, wolframszálas izzólámpa (Spektrálisan folytonos eloszlásúak).
Ne-, Kr-, Ar-töltésű csövek, fénycső, Xe villanó lámpa (fényképezés, diszkó), utcai nagynyomású higanygőz- és nátrium lámpák (vonalasak). Lézerek („vonalasak”).
Lézerekről
A legegyszerűbb csoportosítás a lézerközeg fajtája szerint lehetséges:
- szilárdtest lézerek
- gáz (atom, ion vagy molekula) lézerek
- folyadék- (festék-) lézerek
- félvezető lézerek
- egyebek (pl. szabad-elektron-lézer, kémiai lézer)
Szilárdtest lézerek
Aktív anyaguk szigetelő típusú kristály vagy üveg. A lézerátmenet többnyire a szennyező ion egy átmenete (pl. Cr3+ vagy Nd3+). Az átmenet az ion belső, betöltetlen nívói között jön létre. A nívók élettartama megfelelően hosszú.
Rubinlézer: Az első működő lézerfajta volt 1960-ban. Gerjesztése villanó lámpával lehetséges. Szokásos működtetése impulzus üzemben történik. Q-kapcsolással az elérhető teljesítmény 10–50 MW 10-20 µs impulzusidő mellett.
Neodymium lézerek: A legnépszerűbb szilárdtest lézerfajta. A lézerközeg Y3Al5O12 (ittrium-aluminium-gránát, YAG), amiben néhány Y3+ helyett neodymium (Nd3+) ion van, vagy üveg (Nd-YAG ill, Nd:üveg lézer). Gerjesztése villanó vagy folytonos lámpával, egyre terjedőben van a félvezető lézerrel. Működése lehetséges folytonosan, ekkor a maximális teljesítmény ~1000 W is lehet már, impulzusban (Q-kapcsolva 50 MW ); Leggyakoribb hullámhossza az 1,06 µm, de szokás frekvenciáját kétszerezni.
Gázlézerek: e4_ea.
Semleges atomlézerek: e4_ea.
Molekula–lézerek: e4_ea.
Folyadéklézerek: Az oldott szerves festékek nagy molekulák konjugált kettős kötésekkel. UV-ben vagy láthatóban vannak erős elnyelési sávjaik, a gerjesztést széles sávú fluoreszcens spektrum kibocsátása követi. Lézerműködéshez a gerjesztés lehetséges másik lézerrel - pl. excimer vagy Ar-ion lézerrel. A gerjesztett festék lézerként széles sávban hangolható.
Félvezető lézerek: A legjobban fejlődő területe a lézertechnikának. Az első félvezető lézer már 1962-ben elkészítették, alapanyaga GaAs volt. A félvezető technikában szokásos p-n átmeneten az átfolyó árammal hozható létre inverz betöltöttség ezekben a lézerekben. A fényvisszacsatolást biztosító optikai rezonátor egyszerűen a félvezető hasított felületével alakítható ki. A nagy törésmutató (pl. nGaAs=3,6) miatt a reflexió egyéb réteg alkalmazása nélkül is elegendően nagy a félvezető-levegő határfelületen. Tipikus méretei: néhány µm az aktív tartomány vastagsága, 100-200 µm a szélessége és 200-500 µm a hossza. A kis méretek és az alacsony, néhány V-os működési feszültség (vagy néhány mA-es áram) miatt igen könnyen, olcsón működtethető. A jelenlegi technikai szint alapján a következő hullámhosszakon működnek félvezető lézerek:
- 0,65-0,68 µm (ez a fajta helyettesíti egyre inkább a He - Ne lézereket),
- 0,78 µm (az optikai memóriákban leginkább elterjedt típus),
- 0,82 µm (főleg írható optikai memória-rendszerekben és rövid távolságú adatátvitelnél használják),
- 1,3, 1,5 µm (kommunikációs célokra),
Az elektronikai alkalmazások során a lézerek tipikus teljesítménye néhány mW. Az anyagmegmunkálásra kifejlesztett diódasorok elérik az 1 kW összteljesítményt.