ATOMFIZIKA - ELŐADÁS ANYAG
Az elemi töltés létezésére vezető tapasztalatok. Az elektron töltése
Az elektron fajlagos töltése J.J.Thomson kísérlet alapján
Hőmérsékleti sugárzás. Planck-féle sugárzási törvény
Külső fotoeffektus. Einstein egyenlet.
Az energia kvantumos gondolata. H-atom színképe. Atomszínképek.
Az elemi töltés létezésére vezető tapasztalatok. Az elektron töltése
Az elektrolízis Az elektrolitokban (savak, lúgok, sók vizes oldatai) a beléjük merülő elektródákon keresztül áram folyik; gáz, vagy szilárd anyag válik ki.
Faraday tapasztalati törvényei:
Az m
tömegű anyag kiválasztásakor:
![]() (a1.1)
(a1.1)
A molnyi mennyiség kiválasztásához 96500 C töltés szükséges.
Létezik egy
legkisebb töltés:
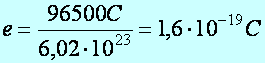 (a1.2)
(a1.2)
A Millikan-féle kísérlet (1906): (1868-1953):
Kísérlet leírása: Vízszintes síkkondenzátor közé olajcseppeket porlasztva, a feszültséggel szabályozni lehet, melyik ne essen le.
Kvalitatív értelmezés: A porlasztáskor, elektrosztatikus megosztás során adott töltés mennyiségre tett szert az olajcsepp.
Kvantitatív következtetés: Ha az olajcsepp lebeg, akkor súlyával (G=mg) azonos nagyságú az elektromos tér hatása (F=QE). Mindegyik olajcsepp összes töltése, egész számú többszöröse egy értéknek, az elemi töltésnek (e). Az elektronok mozgékonyságának feltételezésével, feltételezhető, hogy ez az érték az elektron töltése lehet.
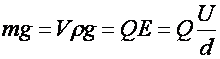 eredmény
eredmény
![]() (n=1,…i.) (a1.3)
(n=1,…i.) (a1.3)
Tétel:
A töltés kvantuma, az elemi töltés
értéke:
![]() (a1.4)
(a1.4)
A Richardson hatás (1879-1959), termikus elektron emisszió: (tapasztalható: katódsugárcsőben, csöves oszcilloszkópban, TV-képcsőben, monitorban).
Az elektron fajlagos töltése J.J. Thomson kísérlete alapján
Kísérlet leírása: J.J. Thomson (1856-1940) (1897) Egy katódsugárcsőben a katódot izzítjuk. Az anód-katód között ismert gyorsító feszültséget (U) alkalmazunk, ami mérhető, anód után kirepülő töltött részecskék (elektronok?) ismert (tekercs árama, mérete, mágneses szuszceptibilitása mérhető) homogén mágneses térbe (B) kerülnek, körpályán mozognak, a körpálya sugara (R) mérhető.
Kvalitatív értelmezés: A változtatott elektromos térerősség és a mágneses térerősség értékekből, megállapítható a mozgó töltött rész neme: negatív, az izzó katódból elektronok lépnek ki.
Kvantitatív következtetés:
A jelenség leírására két törvényszerűség, két egyenlet írható fel a mérésadatokból A két egyenletből meghatározható két ismeretlen, a részecske sebessége (v) és a fajlagos töltése (q/m):
Dinamika
alapegyenlete:
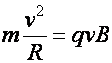 Þ
Þ
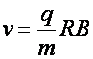 (a1.5)
(a1.5)
Munkatétel az
elektromos térre
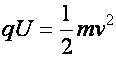 (a1.6)
(a1.6)
Þ
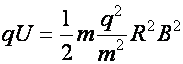 a fajlagos töltés:
a fajlagos töltés:
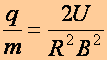 (a1.7)
(a1.7)
Tétel: A Millikan-féle kísérletből az elemi töltés értékét felhasználva az elektron tömege:
![]() (a1.8)
(a1.8)
A kapott eredmények összevetése más elmélet eredményével: (Atomszerkezeti értelmezés, atommodell): A Stuart-Tollmann-féle (elektronok tehetetlenségének kimutatása), és a Lenard Fülöp-féle (külső fényelektromos effektus) kísérletnek megfelelően fémekben vannak szabad elektronok, amelyek nagyon kis energia hatására (2-3 eV) kiléphetnek a fém felületéről, elektromos és mágneses tér gyorsító hatást gyakorol rájuk.
Hőmérsékleti sugárzás. Planck-féle sugárzási törvény
1. Wien-féle eltolódási törvény (1893):
![]() , (a1.9)
, (a1.9)
2. Stefan-Boltzmann-törvény:
![]() (a1.10)
(a1.10)
![]() (a1.11)
(a1.11)
3. Planck-féle sugárzási törvény (1900) Planck (1858-1947):
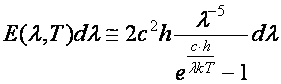 (a1.11)
(a1.11)
![]() (15.11)
ahol a Planck-állandó, (energiakvantum)
(15.11)
ahol a Planck-állandó, (energiakvantum)
![]() (a1.12)
(a1.12)
Külső fotoeffektus. Einstein egyenlet
Kísérlet leírása: Alkalmazzunk egy két elektródás vákuumcsőre, amelynek a katódja pl. cinkből legyen. Mérjük érzékeny árammérővel az áramkörben az áramot akkor, ha nem esik fény a katódra és akkor is, amikor különböző színű (vörös, zöld, kék, ibolya) és intenzitású fény bocsátunk. Tapasztalat: sötétben nincs áram, vörösnél szintén nincs, akármilyen erős is a vörös fény. Nagyon gyenge kék, sőt még inkább ibolya fény esetében van áram és nő az intenzitással.
Kvalitatív értelmezés: Feltesszük, hogy ebben az esetben is elektronok lépnek ki a fémből. Azonban egy elektron kilépéséhez szükséges egy adott értékű munkavégzés (kilépési munka). Ezt a szükséges értéket az ibolya és a kék színű fény adagokban tudja fedezni, az intenzitás növelés pedig ezeknek az adagoknak a számát növeli. A vörös fényben egy adagnak a nagysága nem éri el az egy elektron kiléptetéséhez szükséges munkát.
Összefoglalva: Az anyagban kötött elektron egyszerre csak egy fotonnal lép kölcsönhatásba. A fény nem folytonosan, hanem adagokban, kvantumokban szállítja az energiát.
Kvantitatív következtetés:
Az energiakvantum (neve: foton) nagysága arányos a fény frekvenciájával:
![]() (a1.13)
(a1.13)
Tétel: Einstein-féle egyenlet: ahol W jelentése kilépési munka.
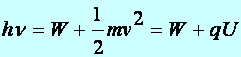 (a1.14)
(a1.14)
Ellentér módszerrel mérhető a kilépési munka.
Az energia kvantumos gondolata. H-atom színképe. Atomszínképek.
A
spektroszkópiai méréseredmények:
(Kirchoff, Bunsen, ) ábrázolásánál, összevetésénél, alkalmazott
„technika” az energiaszint (E) szerinti (term, T) ábrázolás. A foton
energiaszintjeinek egységei a következők: aJ, eV,
![]() .
.
A hullámhossz-frekvencia és a hullámhossz- hullámszám kapcsolatot felhasználva:
![]() , ahol
, ahol
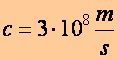 (a1.15)
(a1.15)
az energia szintek értékeit a következő összefüggésekkel lehet számítani:
![]() , ahol
, ahol
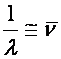 a hullámszám
(a1.16)
a hullámszám
(a1.16)
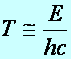
![]() (a1.17)
(a1.17)
A Hidrogén atom színképe
A hidrogén által kisugárzott fény látható tartományba eső vonalainak hullámhossza, frekvenciája, hullámszáma, és az adott foton energiája (aJ) és (eV) egységekben (10-18 J= aJ; 1 eV = 1,6 10-19 J= 0,16 aJ; 1 aJ = 6,25 eV; 1 aJ=50,256 103 cm-1):
|
Vonal jele |
l (nm) |
n (THz) |
|
E(aJ) |
E(eV) |
|
a |
656,4 |
457,3 |
15235 |
0,303 |
1,89 |
|
b |
486,3 |
617,3 |
20563 |
0,409 |
2,56 |
|
g |
434,2 |
691,2 |
23031 |
0,458 |
2,86 |
|
d |
410,3 |
731,7 |
24372 |
0,485 |
3,03 |
|
e |
397,1 |
755,7 |
25183 |
0,501 |
3,13 |
Balmer-formula (1885). Balmer (1825-1898) próbálkozással kialakított egy képletet, amelyből mindegyik hullámhossz értéket származtatni lehet:
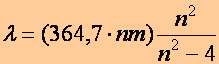 (n=3,
4, 5, 6) (a1.18)
(n=3,
4, 5, 6) (a1.18)
Balmer után az előzőből egy általánosabb alakot fejeztek ki, amely alapján „csoportokba lehet rendszerezni” a hidrogén későbbiek során kimért spektrumvonalait is. A teljes rendszer az „osztályozás” után a következő:
|
Lyman-sorozat |
1906 |
k=1 |
n=2, 3, 4, 5,.. |
|
Balmer-sorozat |
1885 |
k=2 |
n=3, 4, 5,.. |
|
Paschen-sorozat |
1908 |
k=3 |
n=4, 5, 6,.. |
|
Brackett-sorozat |
1922 |
k=4 |
n=5, 6, 7,.. |
|
Pfund-sorozat |
1924 |
k=5 |
n=6, 7, 8,.. |
A Rydberg-féle képlet foglalja mindezeket egységbe: (Rydberg, 1854-1919)
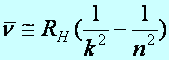
![]() (a1.19)
(a1.19)